什么是锂离子电池?
时间:2019-09-18 21:40来源:英能聚 作者:elcogy
点击:
次

锂离子电池是以含锂的化合物作正极,在充放电过程中,通过锂离子在电池正负极之间的往返脱出和嵌入实现充放电的一种二次电池。锂离子电池实际上是锂离子的一种浓差电池,当对电池进行充电时,电池的正极上有锂离子脱出,生成的锂离子经过电解液迁移到负极,并嵌入到负极材料的间隙中;放电时,嵌在负极材料中的锂离子脱出,迁移回正极。锂离子电池内部主要由正极、负极、电解质及隔膜组成。正、负极及电解质材料不同及工艺上的差异使电池有不同的性能,并且有不同的名称。
目前市场上的锂离子电池正极材料主要是钴酸锂(LiCoO2),另外还有少数采用锰酸锂(LiMn2O4)及镍酸锂(LiNiO2)作正极材料的锂离子电池,一般将后两种正极材料的锂离子电池称为“锂锰电池”及“锂镍电池”。磷酸铁锂动力电池是用磷酸铁锂(LiFePO4)材料作电池正极的锂离子电池,它是锂离子电池家族的新成员。
锂离子电池的充放电原理(以石墨负极、LiCoO2正极为例)如图1所示
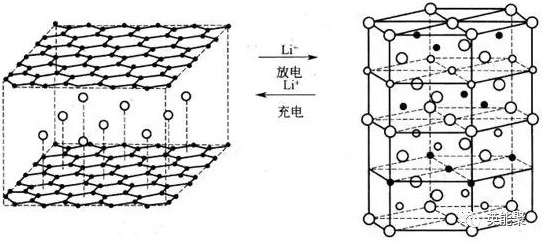
图1锂离子电池的充放电原理示意
锂离子电池储能技术优点:
1.能量密度高,三元电芯单体能量密度最高可达200Wh/kg,磷酸铁锂电池最高可达160Wh/kg。
2.具有超长的循环寿命,目前三元电池最高循环寿命可以突破4000次,磷酸铁锂电池更是可以达到6000次以上。
3.功率密度大,按照特定的设计,可以达到2C甚至4C左右的大型储能功率输出。
锂离子电池储能技术还存在以下缺点:
1.生产成本比铅酸电池略高,但是目前随着1号铅价的上涨和锂电池生产成本下降,目前储能锂离子电池与铅酸电池之间的价格差已经逐年缩小;
2.无论是三元锂离子电池或磷酸铁锂电池,大规模储能应用都需要搭配BMS电池管理系统使用,增加了储能系统的成本;
3.三元锂离子电池,因为其材料性能,还是存在安全性的隐患,对BMS管理系统的要求高。如果BMS系统出现失误,则很容易造成起火爆炸。
1.1磷酸铁锂与三元电池基本原理
1.1.1磷酸铁锂基本原理
磷酸铁锂价格低廉,资源丰富、无环境污染。而且LiFePO4具有适中的电位平台和较高的比容量,结构也非常稳定。LiFePO4为有序的橄榄石结构,属正交晶系(Pmnb空间群),每个晶胞中有4个LiMPO4单元。其结构如图2所示。在LiFePO4的晶体结构中,氧原子近似于六方紧密堆积,磷原子在氧四面体的4c位,铁原子、锂原子分别在氧八面体的4c位和4a位。在b-c平面上,FeO6八面体通过共点连结;一个FeO6八面体与两个LiO6八面体和一个PO4四面体共棱,而一个PO4四面体则与一个FeO6八面体和两个LiO6八面体共棱。Li+在4a位形成共棱的连续直线链,并平行于c轴,从而Li+具有二维可移动性,使之在充放电过程中可以脱出和嵌入。

图2磷酸铁锂的晶体结构图

图3磷酸铁锂电池充放电过程示意图
如图3所示为磷酸铁锂电池的电化学反应方程式:
正极反应:LiFePO4⇔ Li1-xFePO4+ xLi++ xe-;
负极反应:xLi++xe-+6C⇔LixC6;
总反应式:LiFePO4+6xC⇔Li1-xFePO4+LixC6。
其理论比容量为170mAh/g,并且在3.5 V附近有非常平坦的充放电电位平台。
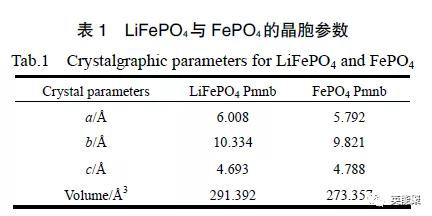
图4 LiFePO4与FePO4的晶胞参数
通过表4中可以看出LiFePO4在充放电过程中发生的体积变化也很少,两者同属一种空间群,在结构上极其相似。在充电过程中,LiFePO4晶胞的a、b轴略有缩短,而c轴有所增长,整个过程材料的体积仅收缩约6 %。因此,LiFePO4在反复充放电过程中能够保持结构的稳定性,循环可逆性能高。同时,LiFePO4的体积收缩刚好可以弥补碳负极在充电过程中膨胀,这样整个电池内部的总体积变化很少,从而提高了整个锂离子电池的体积利用率。
LiFePO4的高温稳定性明显优于其它材料,P-O键能使得结构稳定不易受锂离子脱嵌的影响,使得磷酸铁锂正极材料具有良好的热稳定性,与有机电解液的反应活性也很低。从室温到85℃范围内,LiFePO4不会与含LiBF4、LiAsF6或LiPF6的EC/PC或EC/DMC电解液发生反应。因此,以LiFePO4作正极材料的锂离子电池具有很好的安全性与循环可逆性能,在较高的温度下,LiFePO4的倍率性能也有所提高。
1.1.2三元锂离子基本原理
按照过渡金属离子相对含量的不同,商业化的三元系列的材料可分为以下几种,即LiNi1/3Co1/3Mn1/3O2(简称111三元),LiNi0.4Co0.2Mn0.4O2(424),LiNi0.5Co0.2Mn0.3O2(523),如图5所示为不同配比的三元电池理论比容量,111相的理论比容量达到183 mAh/g,424相的达到223 mAh/g,且镍含量越高,理论比容量越高,但是进入镍位的锂离子脱出较为困难,即高镍意味着循环性能的减弱。
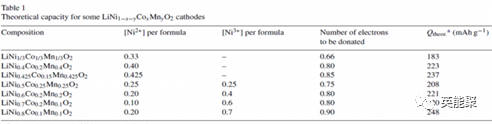
图5不同配比三元正极材料理论比容量
其中111三元应用最为广泛,以111三元为例,具有和LiCoO2十分相似的α-NaFeO2层状结构,如图7所示,111相为空间群为P3112的超晶格结构(a = 4.959 Å, c =14.245 Å),其中过渡金属元素Co、Ni、Mn分别以+3、+2、+4价态存在,锂离子占据岩盐结构的3a位,镍、钴和锰离子占据3b位,氧离子占据在共边MO6(M = Ni、Co或Mn)八面体的空隙6c位。对于其它三元组成,若Ni2+含量过高时,由于Ni2+的离子半径(0.69 Å)与Li+的离子半径(0.76 Å)相近可导致锂镍混排,进入镍位的锂在充放电过程中脱出困难从而导致循环性能恶化及比容量降低。

图6 111相三元正极材料晶体结构图
Li(Ni,Co,Mn)O2中,各过渡金属离子作用各不相同,Mn4+的作用在于降低材料成本、提高材料安全性和结构稳定性。但过高的Mn含量会破坏材料的层状结构,使材料的比容量降低。Co3+的作用在于不仅可以稳定材料的层状结构,而且可以提高材料的循环和倍率性能。而Ni2+的作用在于提高增加材料的体积能量密度。但镍含量高(即高镍)的三元材料也会导致锂镍混排,从而造成锂的析出。
以111三元为例,在充电过程中的电化学反应式为:

可以看出三元的充电过程电化学反应较为复杂,不同的电位均存在不同的反应过程,由于其类似于LiCoO2的层状晶体结构,可以较为轻松的多次脱嵌锂离子,使得其容量和能量密度很高。但是,随着电位的升高,氧的平均价态有所降低,有晶格氧从结构中逃逸,化学稳定性遭到破坏,并且若脱锂量过高,会产生MO2新相,新相的产生极有可能会刺穿隔膜,导致电池内短路,产生安全隐患。因此三元电池就材料本身具有较高的热失控风险。
免责声明:本文仅代表作者个人观点,与中国电池联盟无关。其原创性以及文中陈述文字和内容未经本网证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
猜你喜欢
-
美国ION公司固态电池新突破:超125次循环,容量衰减低于5%
2024-03-11 22:56 -
电池圈里,没有共同富裕
2023-05-17 09:20 -
锂离子电池隔膜的主要性能参数有哪些?
2023-01-24 18:18 -
技术层面的锂电好产品是否一定能帮公司业绩兑现?
2023-01-24 18:16 -
锂电产业如何利用视觉检测系统降本增效?
2023-01-24 18:11 -
电动车市场开启降价潮, 问界与小鹏之后零跑跟风!
2023-01-24 18:10 -
震裕科技拟3亿元投建锂电池铝壳生产项目
2023-01-10 15:53 -
简述宁德时代的电池技术断代
2022-09-06 09:32 -
铅酸、镍镉、镍氢、锂电池优缺点对比
2022-06-21 08:42 -
为废旧电池开疆拓土!废旧NCM与双功能催化剂实现梦幻联动!
2022-05-19 11:46
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
专题
相关新闻
-
美国ION公司固态电池新突破:超125次循环,容量衰减低于5%
2024-03-11 22:56 -
电池圈里,没有共同富裕
2023-05-17 09:20 -
锂离子电池隔膜的主要性能参数有哪些?
2023-01-24 18:18 -
技术层面的锂电好产品是否一定能帮公司业绩兑现?
2023-01-24 18:16 -
锂电产业如何利用视觉检测系统降本增效?
2023-01-24 18:11 -
电动车市场开启降价潮, 问界与小鹏之后零跑跟风!
2023-01-24 18:10 -
震裕科技拟3亿元投建锂电池铝壳生产项目
2023-01-10 15:53 -
简述宁德时代的电池技术断代
2022-09-06 09:32
本月热点
-
2024锂电池行研报告
2024-05-24 18:59 -
小米入局电池制造,与宁德时代成立合资公司!
2024-05-20 19:05 -
多个锂电项目终止,重磅文件引导企业单纯扩大产能!
2024-05-15 19:12 -
携手多地政府,这家企业5月三大电池项目开工/签约!
2024-05-21 18:46 -
重磅!新能源突传三大利好!固态电池赛道即将爆发
2024-05-28 18:18 -
投资超25亿元!这家锂电企业拟在美国建设电池化学品项目
2024-05-22 19:20 -
又一10GWh项目开工,固态电池距离产业化还要多久?
2024-05-11 19:17 -
宁德时代、比亚迪、中创新航共同供货蔚来“乐道”?
2024-05-09 18:48


 微信公众号
微信公众号







