当前位置: 绿色智汇能源技术研究院 > 前沿 >
锂离子电池三元层状正极材料研究进展
时间:2024-02-18 09:28来源:粉体网 作者:乔木
点击:
次
01
前言
锂离子电池因为能量转化效率高、循环使用寿命长以及环境友好等优点,被广泛应用于便携式笔记本、智能手机和电动汽车等领域。随着锂离子电池在新能源汽车领域应用逐步扩大,续航里程成为制约新能源汽车发展的关键因素,提高锂离子电池的能量密度是解决续航焦虑的有效途径。锂离子电池主要由正极材料、负极材料、隔膜和电解液组成,相比于其他组成部分,正极材料占据锂离子电池近一半的成本,是影响电池安全性能和能量密度的关键所在。
正极材料对于锂离子电池的开路电压、容量、成本、安全性等方面具有重要的作用。研究比较广泛的锂离子电池正极材料可分为以下几类:
(1)层状结构正极材料LiMO2(M=Ni、Co、Mn等),
(2)尖晶石结构正极材料LiMn2O4,
(3)橄榄石结构聚阴离子型正极材料LiFePO4[5-6]。
近些年来,在单金属层状正极材料基础上发展而来的三元层状结构正极材料LiNixCoyMzO2(后文简称三元正极材料)以其独特的优势成为研究者关注的热点。
三元层状过渡金属氧化物正极材料综合了LiCoO2、LiNiO2和LiMnO2三种材料的优点,Ni、Co和Mn元素之间存在明显的协同效应,因此三元正极材料的性能好于单一组分层状正极材料。
首先,相对于其他正极材料,三元正极材料具有更高的能量密度。富锂三元材料可达到1000 Wh/kg,高镍三元材料也可达到800 Wh/kg。这种能量密度使得高巡航里程电动汽车的普及成为可能。
其次,三元层状过渡金属氧化物成本较低,使用寿命较高,具有优异的性价比。在可获得高比能的前提下,三元正极材料的造价相对适中,处在钴酸锂和磷酸铁锂之间。最后,三元正极材料中的三种过渡金属比例可调,可以根据产品需求任意组合出具有期望特性的产品,进一步提高性价比。比如提高镍的含量可以明显提高材料的容量,提高锰的含量材料的稳定性可以得到加强。
02
三元层状正极材料的发展
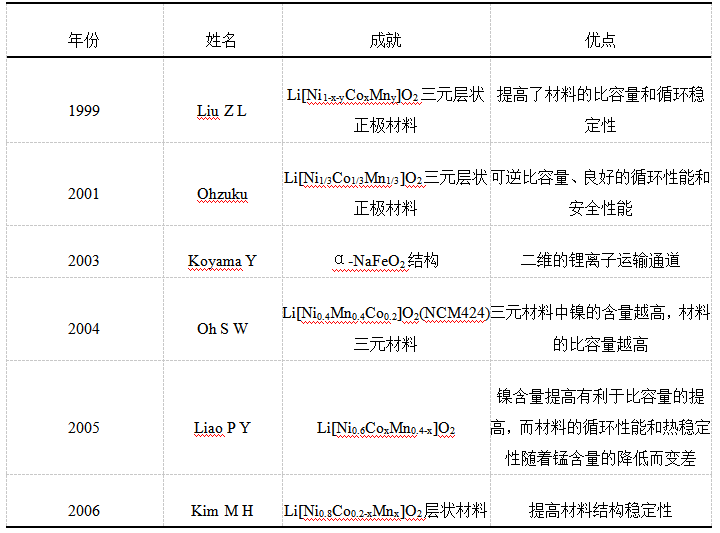
由于单一过渡金属层状氧化物都存在自身不可避免的缺点,LiCoO2层状材料的实际放电比容量较低,LiNiO2和LiMnO2层状材料的结构稳定性及安全性能较差,因此难以在动力电池领域商业化应用,随着对正极材料研究的不断深入,单一过渡金属层状材料逐步发展到三元层状正极材料[7]。三元层状正极材料的发展进程如表一所示。
表1 三元层状正极材料的发展进程

03
三元层状正极材料存在的问题
虽然三元正极材料有诸多优势,也存在一些不可避免的缺陷。比如阳离子混排;结构退化;微裂纹;表面副反应;热稳定性等问题。研究高镍三元层状正极材料的结构退化机理以及容量衰减机制对于提高其循环稳定性与安全性能具有重大指导意义。
3.1 阳离子混排
三元层状正极材料在材料合成阶段和电化学循环过程中易发生阳离子混排,即层状结构中位于3a位置的过渡金属离子与位于3b位置的锂离子发生部分占位的现象。
Ni2+离子半径为0.69 A(1A=0.1 nm),Li+离子半径为0.76 A,两种离子半径相近,容易占据彼此的位点造成Li+ /Ni2+混排。
其他两种过渡金属离子Mn4+和Co3+虽然也存在混排的可能性,但与Ni2+相比则小得多。
这种现象对倍率性能(Li+扩散速率)、循环稳定性(结构稳定性)、首圈循环效率等电池性能产生不利影响。
但近期有研究表明,对于 Li(NixMnyCoz)O2 (NMC,x+y+z=1)材料而言,适当的锂镍混排对电化学循环过程中的结构稳定有益。
优化材料的合成参数可以调控其阳离子混排程度,可通过降低 Ni2+含量减少混排,如对于锂过量的层状材料,当发生混排后 Li+进入过渡金属层,那么过渡金属层一定会有一部分Ni2+氧化为Ni3+来达到电荷守恒,抑制了在充放电循环过程中进一步混排的趋势。
3.2 热稳定性
安全问题是LIBs在汽车工业中大规模电源应用的第一要旨,当电池处于过度脱锂态,材料结构极不稳定,易与可燃性电解液反应导致相变并伴随着热量和气体的释放。一般的商用的层状氧化物正极过度充电或加热通常会导致氧分子从晶格中释放。
碳酸盐基电解质溶剂高度易燃,脱锂正极和释放的氧会作为氧化剂在高温下将其热诱导分解放热,当产生的热量过高而不能自我消散时,会导致整个电池系统燃烧,这一过程称为热失控。
锂离子电池热失控导致的安全性问题是阻碍锂离子电池广泛应用于动力电池领域的主要原因之一,提高正极材料的热稳定性有利于减少热失控问题的发生。
NCM 三元正极材料的结构稳定性和热稳定性随着镍含量的增加而降低,随着钴和锰含量的增加而增加,高镍三元正极材料的高比容量特性以牺牲热稳定性和安全特性为代价,因此,提高高镍层状氧化物阴极的安全性能,应提高其放热反应的起始温度,减少放热反应的发生。
3.3 微观应变和颗粒内部的微裂纹
在充电过程中,高镍层状材料的晶胞沿003晶面(c轴)方向发生膨胀并沿 a/b 轴方向收缩,放电过程晶胞参数的变化规律相反,这种各向异性的膨胀和收缩使材料内部的离子键产生较大的应力,并会导致一次/二次颗粒内部的分离和破裂,这就是微观应变。随着锂离子脱嵌循环的不断进行以及脱锂深度的提高,微观应变会有所加剧。
微观应变使二次粒子之间产生空隙,进而使电解液渗透到颗粒之间,最终导致电极材料中过渡金属离子的溶解和材料开裂。
3.4 表面副反应
三元正极材料在合成以及电化学循环过程中难免会与空气中的成分以及电解液接触发生副反应,产生的副产物会严重影响电池的循环稳定性及安全性能。
在合成高镍正极材料的过程中,正极材料表面的残锂会与空气中的CO2、H2O 发生反应形成LiOH、Li2CO3等副产物,阻碍Li+的迁移,还会出现与电解液、聚合物黏结剂等发生副反应并产生气体等现象,导致电池性能恶化。
高镍材料中高活性的 Ni4+和Co4+容易催化电解液的氧化分解反应,产生副产物覆盖在正负极材料表面;同时,释放的O2还可与易燃的有机电解质反应,产生大量热量,从而引发严重的安全危险问题。
此外,富镍材料的表面 Ni-O相与电解质直接接触会发生副反应。副反应生成的化合物附着在电极表面上,例如 LiF、LiO2、Li2CO3和LiOH等,它们的组成与所用电解质的组成密切相关。这些副反应产物具有绝缘性,导致Li+的扩散受阻以及电化学性能恶化。
04
三元层状正极材料常见改性策略
针对三元正极材料所存在的问题,研究人员采取了多种解决方案。通过改性措施来改善材料的电化学性能,主要采取离子掺杂、表面包覆、结构设计等方法。
4.1 表面包覆
表面包覆改性是被广泛用于三元正极材料表面修饰的方法之一。表面包覆层根据导电能力的强弱主要分为两种:一种是导电碳或导电聚合物等导电性良好的物质,其可以降低电化学极化和加速电子的传输,改善电极材料的倍率性能。另外一种是导电性差的物质,如一些无机氧化物 、锂盐和磷酸盐类等。
包覆层的主要作用包括:
(1)防止电解质副反应产生的HF腐蚀电极材料;
(2)隔绝电解质与电极材料界面的副反应;
(3)有效抑制电池阻抗的增长,提升锂电池的循环稳定性和延长电池使用寿命。
4.2 元素掺杂
此外,另一种应用比较广泛的方法是将外来过渡金属元素掺杂到层状高镍正极材料中,从而增强了整个颗粒的结构稳定性。通常掺杂元素进入层状高镍正极材料中的位点有 Li 位和过渡金属(TM)位点,根据占据位点的不同,对材料的作用机理也不相同。比如当掺杂元素占据了半径较大的 Li 位,可以充当层状结构的支柱,防止结构坍塌;而占据了过渡金属位点时,有助于形成强金属氧键,抑制锂镍混排,减小体积变形。
4.3 单晶化
大多数高镍三元层状材料以多晶次级粒子的形式存在,这些多晶次级粒子由许多初级粒子组成,由于在电化学循环过程中各向异性收缩和膨胀会导致产生晶间裂纹,尤其是有晶界的二次粒子分级结构会产生更严重的微裂纹,加速电极与电解质界面副反应。
单晶颗粒的独特优点可以有效避免各向异性应力引起的晶间裂纹的形成,从而减轻电极与电解质副反应,增强的界面稳定性能够有效防止材料从层状到岩盐相的不可逆相变,从而提高材料的结构稳定性和循环性能。
4.4浓度梯度结构设计
浓度梯度结构设计是改善高镍三元层状材料结构稳定性的有效策略之一,浓度梯度结构的设计思路最初源于核壳结构,主要包括核壳结构、壳层浓度梯度、全浓度梯度和双倾斜浓度梯度设计策略。
浓度梯度设计的核心思想是使用高镍含量的三元层状氧化物作为内组分,使用镍含量较低的稳定层状氧化物作为外组分,两者分别提供高容量和结构稳定性。从设计角度来看,这些材料通过将提供高容量但不稳定的镍主要置于粒子核心,而将低容量但化学稳定的锰主要置于粒子外部,可以有效解决高比容量和循环稳定性难以平衡的难题。
富锰外层的功能类似于涂层,因为它可以最大限度地减少活性物质与电解质的副反应,但它与涂层的不同之处在于没有非活性组分,所有材料都具有电化学活性,有助于提高容量和导电性。
结语
三元层状正极材料向高镍化发展,提高了电池的能量密度。然而高镍三元正极材料存在阳离子混排、微裂纹形成、表面副反应、热稳定性等主要问题,这些问题制约着高镍三元正极材料的应用。目前主流的改性手段有元素掺杂法、表面包覆法、单晶化等,虽然改性后材料的循环性能和热稳定性有所提高,但是都不能全面解决高镍三元正极材料存在的问题,不同改性策略的综合应用至关重要。
(责任编辑:子蕊)
免责声明:本文仅代表作者个人观点,与中国电池联盟无关。其原创性以及文中陈述文字和内容未经本网证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
猜你喜欢
-
科学家研发土壤微生物燃料电池,为低功耗应用提供新型能源
2024-02-17 11:52 -
用废旧电池将二氧化碳转化为燃料,华科大团队研究成果获《自然》关注
2024-02-02 07:57 -
用AI“造”电池!微软利用AI加速寻找新电池材料
2024-01-10 17:40 -
新微型原子能电池可稳定发电50年
2024-01-09 09:52 -
新能源汽车不怕冷了 新技术让-20℃电池容量提升60%
2024-01-08 17:42 -
上海洗霸与上硅所在固态电解质功能化隔膜研究方面取得新进展
2023-12-22 10:06 -
日本厂商研发不含钴的新型锂电池
2023-12-17 20:50 -
“长循环柔性金属电池”取得重大技术突破
2023-12-10 10:31 -
锂离子电池技术实现新突破 工作温度可低至零下70摄氏度
2023-12-08 17:32 -
ONE为宝马iX开发新电池,续航里程978公里
2023-12-03 14:13
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
专题
相关新闻
-
科学家研发土壤微生物燃料电池,为低功耗应用提供新型能源
2024-02-17 11:52 -
用废旧电池将二氧化碳转化为燃料,华科大团队研究成果获《自然》关注
2024-02-02 07:57 -
用AI“造”电池!微软利用AI加速寻找新电池材料
2024-01-10 17:40 -
新微型原子能电池可稳定发电50年
2024-01-09 09:52 -
新能源汽车不怕冷了 新技术让-20℃电池容量提升60%
2024-01-08 17:42 -
上海洗霸与上硅所在固态电解质功能化隔膜研究方面取得新进展
2023-12-22 10:06 -
日本厂商研发不含钴的新型锂电池
2023-12-17 20:50 -
“长循环柔性金属电池”取得重大技术突破
2023-12-10 10:31
本月热点
-
锂业龙头预计2023年净利润同比下降69.76%-79.52%
2024-02-02 08:14 -
美国国防部禁止采购六家中企电池?回应来了
2024-01-22 18:12 -
能量密度180Wh/kg!搭载亿纬锂能大圆柱电池车型上市
2024-02-03 07:31 -
产能严重过剩,多家锂电企业终止上市!
2024-01-23 17:59 -
巨头计划使用中国设备生产磷酸铁锂电池!
2024-01-30 18:00 -
四川探获锂资源近百万吨,为亚洲最大伟晶岩型单体锂矿
2024-01-19 18:16 -
欧阳明高院士:10年来动力电池能量密度提升3倍 成本下降80%
2024-01-21 22:07 -
约8亿元!国内领先电池精密结构件制造商扩产
2024-01-31 17:48
 企业微信号
企业微信号 微信公众号
微信公众号









