氟化提升Li10GeP2S12空气稳定性并实现稳定的全固态锂电池
时间:2023-04-03 08:52来源:康桥电池能源CamCellLab 作者:CCL助手
点击:
次
导语
导读:在众多无机固体电解质中,Li10GeP2S12硫化物固体电解质具有堪比液态电解液的高离子电导率(12mS cm-1),在全固态锂电池中有广阔的应用前景。然而,Li10GeP2S12暴露在湿空气下极易水解生成H2S气体,并引发离子电导率的大幅度下降;
此外,这种电解质对于锂金属本征热力学不稳定,因此在接触界面上会产生离子电子混合导体,加速Li10GeP2P2S12的分解,缩短Li10GeP2S12基全固态锂电池的寿命。
01工作介绍
近日,中国科学院宁波材料技术与工程研究所姚霞银课题组通过使用气相氟化的方法构建了一种具有LiF包覆层的LiF@Li10GeP2S12核壳电解质,并通过密度泛函理论(DFT)证实了这种具有低水吸附能的核壳结构电解质可以有效地抑制H2O分子的吸附和PS43-的水解。
此外,得益于LiF包覆层,LiF@Li10GeP2S12的电子电导率降低了一个数量级,因而抑制了锂枝晶的生长,减少了LiF@Li10GeP2S12与锂之间的副反应,将临界电流密度提高了三倍至3 mA cm-2。利用LiF@Li10GeP2S12组装的LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li全固态锂电池在1 C的倍率下循环1000次后具有94.8%的容量保持率。该文章发表在国际顶级期刊Advanced Materials上。硕士生靳育铭为本文第一作者。
02内容表述
通常,基于软硬酸碱理论的离子取代是提高Li10GeP2S12湿空气稳定性的有效方法。然而,引入新元素不能有效解决Li10GeP2S12基硫化物对锂金属本征热力学不稳的问题。我们提出在硫化物固体电解质颗粒表面引入包覆层可能是一种能够同时满足湿空气和界面稳定性的方法。
在各种各样包覆层材料中,LiF材料不仅具有在极低水溶解度和优异的化学稳定性,此外,其低电子电导率、宽的电化学窗口(0-6.3V)和高的对锂界面能(73.28 meV Å-2)的特性,可以抑制Li10GeP2S12界面反应并抑制锂枝晶生长。基于此,本工作通过氟化法,在Li10GeP2S12颗粒表面引入了LiF包覆层。
1. LiF@Li10GeP2S12的核壳结构表征

图1. (a) LiF@Li10GeP2S12制备示意图;(b) TEM图;(c) SAED图;(d) HRTEM和EDS线扫描图;(e) HAADF-STEM图像和元素分布图;(f) F 1s XPS图。
如图1a所示,将Li10GeP2S12和NH4F充分混合作为前驱体,并在200 ℃下加热,前驱体内的NH4F则会受热分解生成NH3和HF,一旦Li10GeP2S12颗粒与HF气体接触,就会发生如下反应:
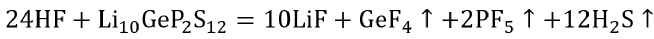
使用密度泛函理论(DFT)计算得出该反应在500 K下的吉布斯自由能为-1026.49 KJ mol-1。Li10GeP2S12颗粒的表面会被腐蚀性的HF迅速氟化,因而自发形成LiF外壳。值得注意的是,在该反应中惰性的NH3气体将不会与Li10GeP2S12反应,反应产物GeF4、PF5均以气体的形式挥发。
通过TEM表征(图1b),发现LiF@Li10GeP2S12颗粒表面出现了一层壳层。为了探究该壳层的具体成分,对其壳层进行SEAD(图1c),距衍射中心7.02、4.97和4.30 nm处分别出现了三个衍射环,可以对应于LiF的(220)、(200)和(111)晶面。
进一步将颗粒边缘局部放大进行HRTEM表征(图1d),LiF@Li10GeP2S12颗粒表面出现了厚度为10nm的包覆层,此外,EDS线扫描图像(图1d)和HAADF-STEM图像(图1e)显示了Ge元素和F元素的相对含量变化,清楚的展现出该包覆层由含F元素形成的化合物。图1f为Li10GeP2S12和LiF@Li10GeP2S12的XPS全谱,很明显,LiF@Li10GeP2S12在684.9 eV的位置处出现了一个强LiF特征峰,验证了LiF壳层的存在。
2. 湿空气稳定性研究
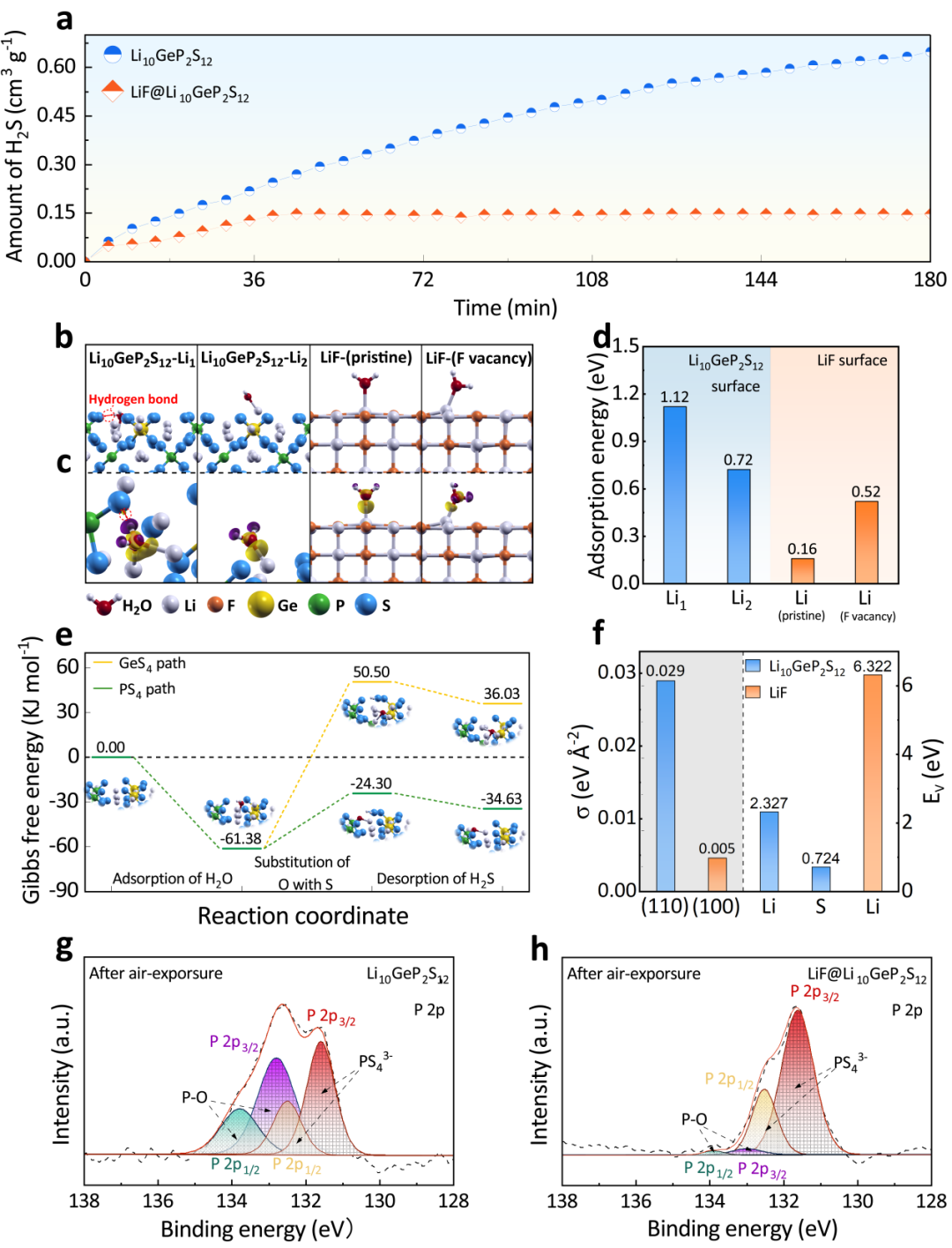
图2. (a) Li10GeP2S12和LiF@Li10GeP2S12的时间-H2S气体释放量曲线;(b-c) Li10GeP2S12和LiF的吸附构型和相关吸附引发的差分电荷密度;(d) H2O在不同吸附位点上的吸附能;(e) H2O在Li10GeP2S12(110)面上沿两种反应路径生成H2S的吉布斯自由能变;(f) Li10GeP2S12和LiF的表面能(σ)和空位形成能(Ev);(g) Li10GeP2S12和 (h) LiF@Li10GeP2S12暴露空气40min后的P 2p XPS精细谱。
将Li10GeP2S12和LiF@Li10GeP2S12暴露在30%相对湿度的湿空气中来评估湿空气稳定性。如图2a所示,LiF@Li10GeP2S12的H2S生成速率为0.00352 cm3 g-1 min-1,在40分钟达到最大值0.1472 cm3 g-1并且直到180分钟都没有H2S气体继续产生,H2S释放总量比Li10GeP2S12低4.4倍。
为了深入了解Li10GeP2S12在湿空气中的水解机理和LiF包覆层的湿空气稳定性,系统地利用DFT计算了原子尺度上水分子的吸附和反应行为。首先,表面上的H2O吸附是水解反应进行的第一步,它可以很大程度上影响了后续PS43-水解并释放H2S的反应,H2O分子的吸附能(Eads)定义为:
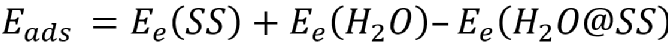
用上述公式对表面吸附位点系统筛选,发现吸附在Li1位点上的水分子可以与附近PS43-形成S-H键(图2b-c),因而获得了最高的吸附能(1.12 eV),随后在S-H键的协助下,O原子会与PS43-基团中的S原子置换,以硫化氢的形式释放到空气中(图2e)。然而,在LiF表面上,H2O吸附能低至0.16 eV,难以实现水分子的吸附。
此外,LiF优异表面稳定性也可以通过其较低的表面能(0.005 eV)证实(图2f)。在LiF@Li10GeP2S12中,Li10GeP2S12具有高H2O吸附能的Li位点在很大程度上被疏水性LiF外壳阻隔,因此有效地减缓了H2O吸附过程和随后PS43-的水解,稳定了LiF@Li10GeP2S12内部Li10GeP2S12的晶体结构。
通过XPS探究湿空气暴露后的物相变化,发现Li10GeP2S12在132.9 eV和133.9 eV结合能处出现了两个强峰,来源于PS43-大量水解产生的P-O键。相反,P-O相关峰的强度在LiF@Li10GeP2S12的谱图上极弱,表明LiF@Li10GeP2S12的PS43-的水解较少。
3. 电化学性能研究
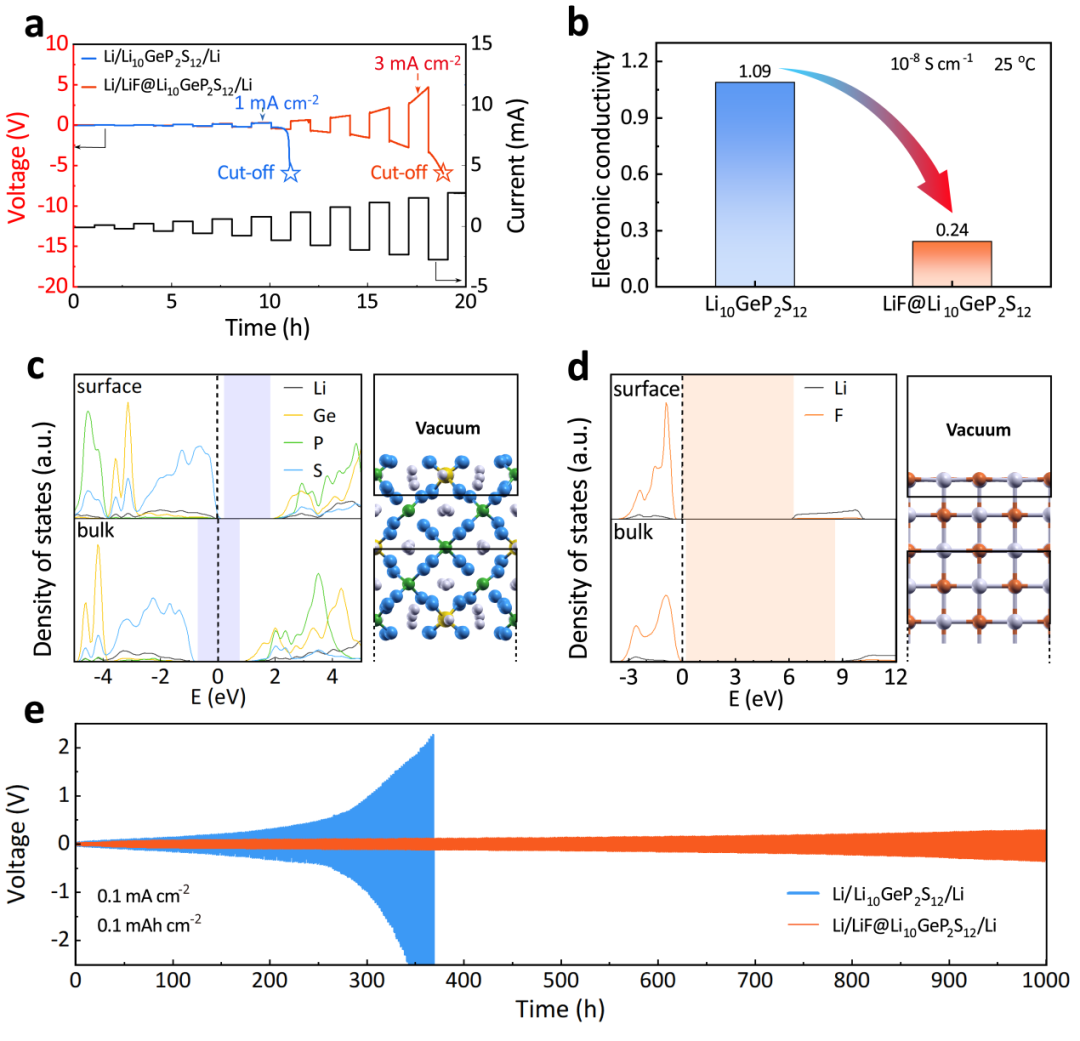
图3. (a) Li/Li10GeP2S12/Li和Li/LiF@Li10GeP2S12/Li对称电池临界电流密度测试;(b) Li10GeP2S12和LiF@Li10GeP2S12的电子电导率对比;(c) Li10GeP2S12和 (d) LiF@Li10GeP2S12的分波态密度;(e) Li/Li10GeP2S12/Li和Li/LiF@Li10GeP2S12/Li对称电池循环性能。
如图3a所示,与Li/Li10GeP2S12/Li对称电池相比,Li/LiF@Li10GeP2S12/Li对称电池的临界电流密度(CCD)值达到了3.0 mA cm-2。通常来说,固体电解质较低的电子电导率能有效的减少锂离子在其内部直接沉积形成锂枝晶,进而获得高临界电流密度。进一步通过直流极化测试探究了电子电导率(图3b),发现LiF@Li10GeP2S12的电子电导率为2.42×10-9 S cm-1显著低于Li10GeP2S12的电子电导率(1.09×10-8 S cm-1)。
分波态密度(PDOS)揭示LiF包覆层的LiF@Li10GeP2S12电子电导率降低的内在机理,如图3c-d所示,一方面,块体的LiF具有比Li10GeP2S12更宽的带隙,表明LiF的绝缘性更高;另一方面,Li10GeP2S12表面具有表面浓度较低(~21012 cm-2)的自掺杂空穴,获得了一定的电子传输能力,而LiF表面的带隙仍然较宽。
因此LiF包覆层能够有效提高LiF@Li10GeP2S12的电子绝缘性。此外,较低的电子电导可以有效地减少电解质与锂金属界面处的电子转移,从而抑制界面副反应的发生。因此Li/LiF@Li10GeP2S12/Li 在0.1 mA cm-2/0.1 mAh cm-2可以实现1000小时稳定的锂离子沉积/剥离并保证极化电压在±0.28 V内。
4. 全固态锂电池的电化学性能研究
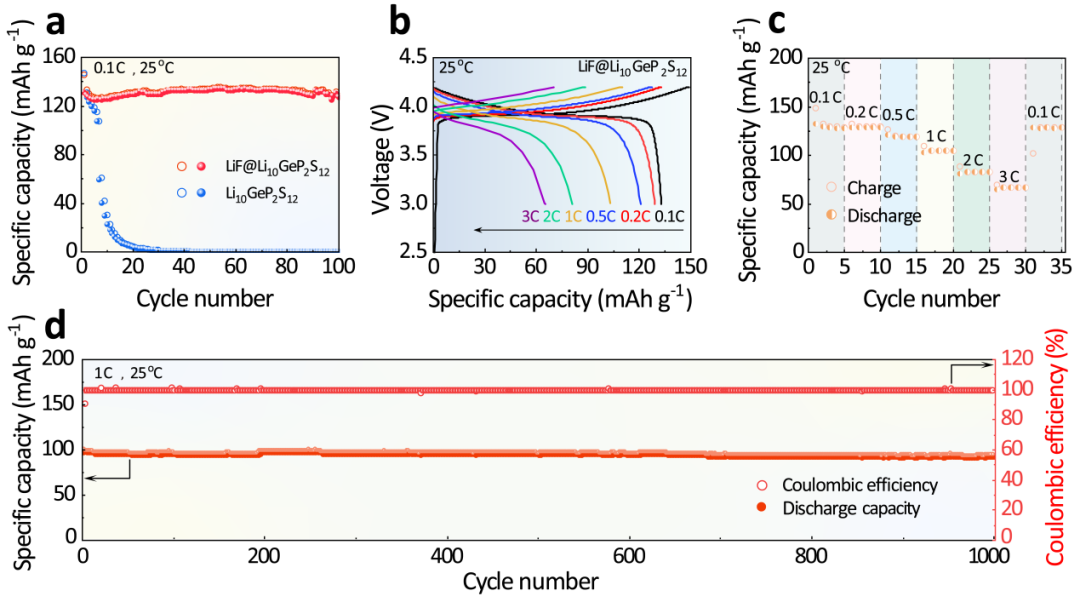
图4. (a) LiNbO3@LiCoO2/Li10GeP2S12/Li和LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li在0.1 C下的循环性能;LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li (b) 在0.1 C到3 C下的充放电曲线以及 (c) 倍率性能和 (d) 1 C下的循环性能。
进一步评估了LiF@Li10GeP2S12在全固态锂电池中的电化学性能。如图4a所示,LiNbO3@LiCoO2/Li10GeP2S12/Li在7次循环后的容量保持率仅为45.4%,难以实现稳定的长循环。而使用LiF@Li10GeP2S12作为电解质的全固态锂电池可以表现出130.8 mAh g-1的初始放电容量,并在100次循环后维持97.0%的超高容量保持率。
测试LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li全固态锂电池的倍率性能(图4b-c),发现全固态锂电池在0.1 C、0.2 C、0.5 C、1 C、2 C和3 C下分别可以提供132.8、128.9、120.7、103.1、80.7和65.1 mAh g-1的可逆放电容量。
得益于LiF超高的界面能,LiF@Li10GeP2S12可以实现均匀的锂剥离/沉积,因此LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li全固态锂电池可以在3 C的倍率下获得较高的可逆容量。测试1 C倍率下的长循环(图4d),LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li全固态锂电池在1 C下能够表现出101.0 mAh g-1的初始放电比容量,在1000次循环后表现出94.8%的优异容量保持率。
显然,LiF@Li10GeP2S12可以极大的减少与锂负极间的副反应,因而在高倍率下获得了优异的循环稳定性。
综上所述,本文通过气相氟化的方法合成了一种具有LiF包覆层的核壳固体电解质LiF@Li10GeP2S12。DFT计算表明,LiF包覆层具有极低的水吸附能(0.16 eV)可以有效地抑制Li10GeP2S12的锂位点与空气中的H2O发生吸附造成PS43-分解。
此外,LiF@Li10GeP2S12具有2.42×10-9 S cm-1的低电子电导率,可以有效抑制锂枝晶生长并阻断与锂负极之间的副反应,因此该电解质的临界电流密度从1.0 mA cm-2提高到3.0 mA cm-2。
使用LiF@Li10GeP2S12组装的LiNbO3@LiCoO2/LiF@Li10GeP2S12/Li全固态锂电池在1 C下具有101 mAh g-1的优异可逆容量和进行1000次循环后高达94.8%的容量保持率。本工作不仅为硫化物固体电解质的水解机理提供了新的理解,而且为设计湿空气和锂金属稳定的硫化物固体电解质提供了新的视角。
免责声明:本文仅代表作者个人观点,与中国电池联盟无关。其原创性以及文中陈述文字和内容未经本网证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
猜你喜欢
-
中国研究人员开发新型预锂化技术 提升锂离子电池的性能
2022-12-29 08:32 -
郑州大学发明新合成方法 可提升锂硫电池电化学性能
2022-12-15 08:42 -
Skoltech提出重新排列正极结构的新方法 将电池能量密度提升25%
2022-11-14 09:13 -
又一个全球首创的技术获得突破!电池能量密度提升3倍,快充5分钟
2022-06-13 11:41 -
电动汽车锂电池能量密度提升10倍的希望!量子技术频获重要进展
2022-04-24 10:37 -
历经10年研究,锂硫电池技术终于成熟,电动汽车的续航再提升三倍
2022-04-06 10:40 -
瑞典采用超声波从汽车电池中提取有价值金属 回收率提升至97%
2021-10-15 09:34 -
日本UNIST寻找锂离子电池中的阳离子替代物 以提升电池放电容量
2021-07-24 18:10 -
Sono Motors为Sino EV引入新电池技术:续航里程大幅提升
2021-06-30 10:31 -
研究人员开发新型电解质 提升锂空气电池循环稳定性
2021-05-14 08:50
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
专题
相关新闻
-
中国研究人员开发新型预锂化技术 提升锂离子电池的性能
2022-12-29 08:32 -
郑州大学发明新合成方法 可提升锂硫电池电化学性能
2022-12-15 08:42 -
Skoltech提出重新排列正极结构的新方法 将电池能量密度提升25%
2022-11-14 09:13 -
又一个全球首创的技术获得突破!电池能量密度提升3倍,快充5分钟
2022-06-13 11:41 -
电动汽车锂电池能量密度提升10倍的希望!量子技术频获重要进展
2022-04-24 10:37 -
历经10年研究,锂硫电池技术终于成熟,电动汽车的续航再提升三倍
2022-04-06 10:40 -
瑞典采用超声波从汽车电池中提取有价值金属 回收率提升至97%
2021-10-15 09:34 -
日本UNIST寻找锂离子电池中的阳离子替代物 以提升电池放电容量
2021-07-24 18:10
本月热点
-
欣旺达透露重大消息!
2023-03-05 11:18 -
隐忍三十年,钠离子电池终于要备胎转正了
2023-03-16 09:32 -
当动力电池产能过剩,“宁德时代们”路归何处?
2023-03-07 08:58 -
动力电池,谁能称王?
2023-03-26 13:02 -
动力电池降价内卷,这次不一样
2023-03-14 11:07 -
下一站,动力电池回收
2023-03-12 11:05 -
市场监管总局:对锂离子电池等产品实施强制性产品认证管理
2023-03-21 09:27 -
锂离子电池高能量密度负极材料研究进展
2023-03-12 11:06
 企业微信号
企业微信号 微信公众号
微信公众号









