全面认识水系非金属载流子电池
时间:2020-10-19 09:37来源:微算云平台 作者:四毛&八毛
点击:
次
成果简介
载流子,即溶液中的阴、阳离子,是电池的基本组成部分,决定电池的电化学原理及性能。非金属载流子是水系电池中替代金属离子的一种选择,具有快速动力学、长循环寿命和低制造成本等优势。非金属带电离子不仅可以通过形成共价-离子键而嵌入电极中,而且还可以作为可逆的氧化还原中心进行电荷转移,其性能优于金属带电离子。
鉴于此,来自香港城市大学的支春义教授、俄勒冈州立大学的纪秀磊教授等人综述了非金属阳、阴离子在水系电池中的物理化学性质、电荷存储机制及与电极的相互作用,并由此建立了基于非金属阳、阴离子为基础的水系电池装置,对电池的成本、容量、工作电位、倍率性能和循环稳定性进行分析。最后,作者重点介绍了基于非金属载流子的水系电池的设计策略以及未来应用。相关工作以《Non-metallic charge carriers for aqueous batteries》为题在《Nature Reviews Materials》上发表综述。
图文导读
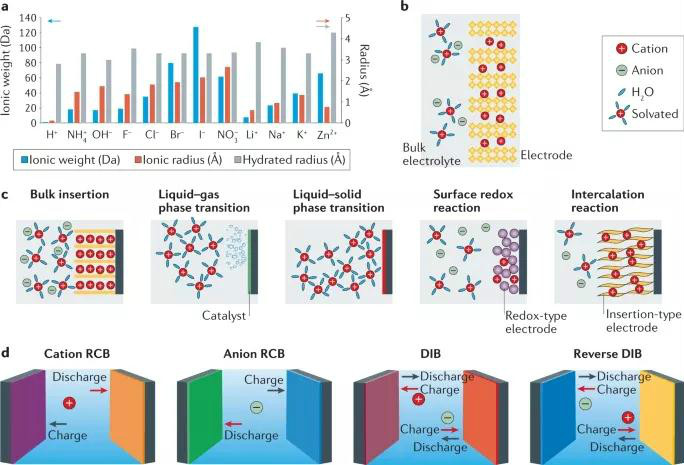
图1 非金属载流子在水系电池中的物理化学性质、电荷存储机制
图1a所示,在非金属离子中,H+的离子质量最低,半径最小,与较大的金属离子如阳离子Li+、Na+、K+、Zn2+相比,H+的能量密度更高,动力学更快。此外,阴离子型非金属载流子通常比阳离子型非金属载流子具有更高的摩尔质量和离子半径,这导致了不同的电池的原理、性能差异。图1b所示,非金属离子在溶剂化和去溶剂下与电极材料相互作用,在非质子溶剂中,溶剂种类和非金属离子的溶剂化作用对电化学性能有很大影响。
电荷存储机制可分为离子插层的摇椅反应机制、固-液-气相中非金属离子的氧化还原、氧化还原赝电容与插层赝电容(如图1c所示)。各电池反应具有不同的反应动力学:扩散限制反应具有电池型行为,而非扩散限制反应具有赝电容型行为。电池的种类可以通过分析电解质中非金属载流子的运动方向来确定:①以阳离子为穿梭离子的摇椅电池;②以阴离子为穿梭离子的摇椅电池;③双离子电池,其中阳离子移动到阳极,阴离子移动到阴极;④反向双离子电池,使阳离子移动到阴极,阴离子移动到阳极。
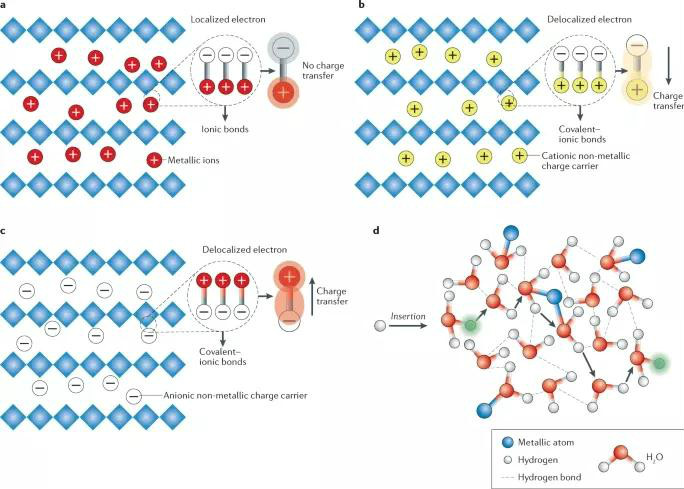
图2 非金属离子与电极的相互作用
Li+离子是电池系统中最常用的金属载流子,其研究主要集中在充放电过程中电极材料的结构演变。Li+离子通过插入电极材料中的相邻层间或其他未占据的四面体或八面体位置,与结构中其他离子形成离子键。例如,在过渡金属氧化物中,Li+插入后与O原子形成Li-O-M键,其中M为过渡金属离子,如图2a所示。而在以阳离子为穿梭离子的摇椅电池中,非金属离子可以与电极中的带负电荷的原子相互作用,形成杂化共价-离子键,如图2b所示。与纯离子键不同,共价-离子键可通过将电子从主电极框架转移到插入的非金属离子上,使电子离域化,非金属离子可作为一个额外的氧化还原中心。
非金属阴离子也能在主电极上形成杂化共价-离子键,由电极中带正电荷的金属原子与之发生相互作用,如图2c所示。而H+离子的插入行为比较特殊,如图2d所示,H+的插入是通过连续的打破/形成与晶格水分子间的氢键,即H+首先通过与O原子形成氢键被吸收到晶格水中,而后所形成的氢键转化为H-O共价键,即原始的H2O中O-H键被打断,从而再次形成氢键,即H2O•••H+。
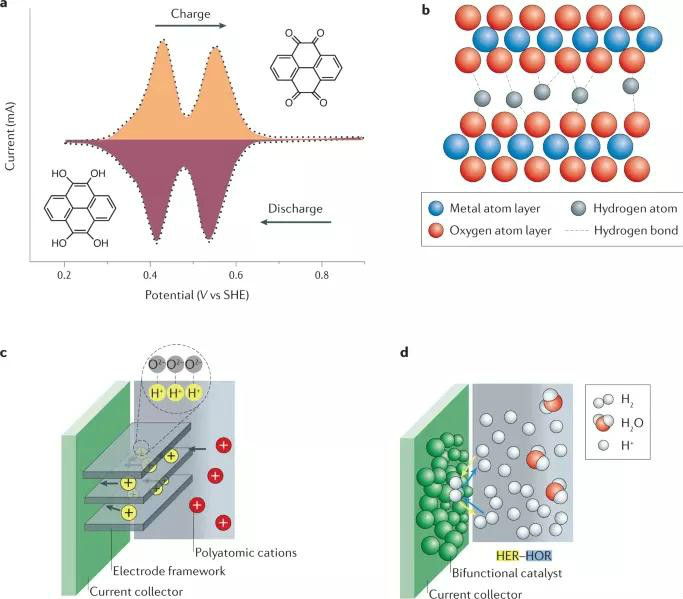
图3 非金属阳离子与电极的相互作用
以多原子阳离子NH4+作为电荷载体为例,与酸性电解质相比,含NH4+的电解质表现出弱酸性和较小的腐蚀性,不会导致电极材料的溶解,比含有H+的电解质有着更高的HER过电位。然而,由于NH4+离子的半径比H+离子大,在嵌入/脱出过程中,电极材料需要更多的空间容纳NH4+离子,这会导致电极结构发生极大的变化。如图3c所示,当发生NH4+离子插入时,根据供体-受体原则,有机物或金属氧化物中O原子可以作为NH4+离子的结合位点。这种离子插入行为与H+的插入行为一致(图3a、b)。此外,值得关注的是,在NH4+离子与电极材料间可通过氢键进行电荷转移,从而可以实现高于金属离子的储能容量。
此外,非金属离子也可以通过转换成中性态来充当氧化还原中心,如利用竞争性反应HER/HOR作为出发点,如图3d所示,从而突破传统插入型电极材料的容量限制。
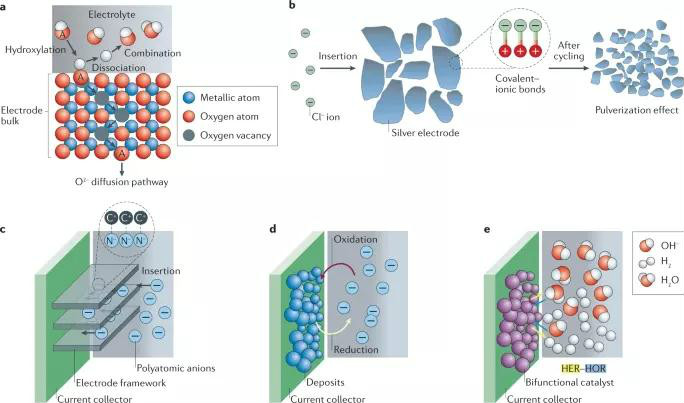
图4 非金属阴离子与电极的相互作用
非金属阴离子电池作为一种新型的电化学储能器件而越来越受到关注。以可充电碱性电池为例,通常由Zn或Fe金属作为阳极,Ni基材料作为阴极组成,溶液中的OH-不仅充当金属络合剂,还参与电极反应。
碱性电池因阴极的不可逆相变而易发生容量衰减。以钙钛矿氧化物的原子模型进行探讨,如图4a所示,在充电过程中,OH-离子首先被吸收,然后通过羟基化过程充满表面。随后,OH-离子解离H+离子(H+离子与电解质中的OH-反应),所形成的O2-离子插入电极中,填充内部的Ov,而在放电过程中O2-离子从电极中脱出。因此,在电极中引入Ov为提高电极容量和动力学,从而提高输出性能提供了一种策略。
此外,Cl-离子也在非水体系中被用作反应载体(在水系环境下,氯化反应导致形成氯盐,而氯盐倾向于溶解在电解质水溶液中)。根据Ag电极可被氧化成AgCl,然后在脱氯过程中还原成银,完成插入-转换过程。这种可逆的氧化还原过程不会引起溶解等问题,然而,长时间的循环会导致Cl电极的形态和形状发生变化,如图4b的电极粉化示意图。
在水系电池中使用多原子阴离子作为反应载体是具有挑战性的,多数多原子阴离子的氧化电位高于氧析出反应(OER)电位。“盐包水”电解质(WiSE)可有效扩大水电解质的电化学稳定窗口,以允许多原子阴离子发生氧化还原。多原子阴离子的脱嵌行为与阳离子类似(图4c),遵循供体-受体原则。类似地,阴离子也可充当氧化还原中心,如Br-/Br3-、I-/I3-电对(图4d)。然而,由于氧化产物的溶解,这样的电池在不使用隔膜的情况下易发生自放电行为。
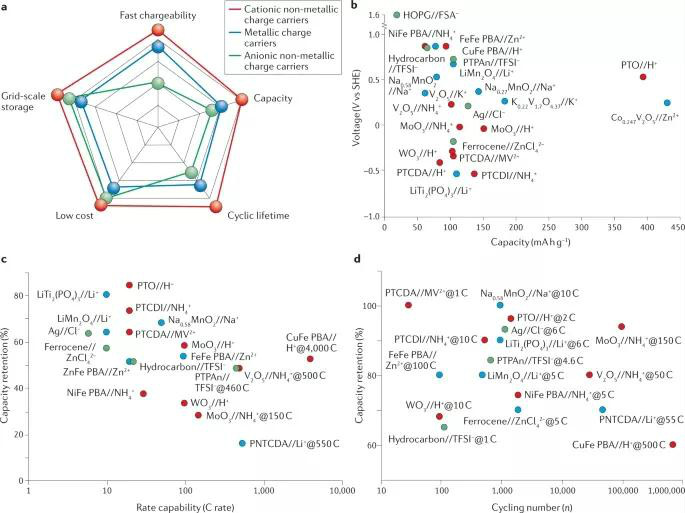
图5 非金属离子电池的性能
不管设计哪一类电池,均要以电池的输出性能为导向。传统地,金属离子一直被认为是默认的反应载荷,而电极材料和电解质是决定电池性能的关键因素。然而,离子种类也将极大影响电池性能、比容量和能量密度。与金属离子载荷相比,非金属离子载荷具有成本低、可大规模储存、充电速度快、容量大、循环寿命长等特点。由于不同的电极材料会导致不同的性能,在这里作者在同一电极上对带正电荷的非金属离子载荷和金属离子载荷的性能进行了评估:
• 成本。成本是通过输送一个存储设施每千瓦电的平均能源成本来评估的。对于水电池系统,除了电池制造成本、维护成本、环境影响和运行成本外,还主要取决于电极材料和电解质成分。因此,可以使用地球丰富的元素和廉价的化学品来降低电解质的成本。如H+、NH4+、I-比金属离子Li+、Zn2+更加廉价。
• 容量。理论容量大的电极材料可以有效提高输出容量(图5b)。在使用相同的电极下,与金属离子相比,非金属阳离子储能具有相当甚至更高的容量,这一方面与他们自身可作为氧化还原中心有关,可通过共价-离子键接受额外的电子,还跟其较小的离子半径有关,可充分利用电极材料的位点。
• 工作电压。非金属阳离子有特定的工作电位区间。通过在同一电解液中选择两个电势相差很大的反应,可以获得较高的输出电压。然而,水电解质的电化学稳定窗口(1.23V)较小,限制了电极材料与反应的选择。使用“盐包水”电解质可有效扩大水电解质的电化学稳定窗口。
• 倍率性能。在电极中扩散能垒较小的非金属离子可有效提高电池的倍率性能。此外,离子半径较小的H+具有超高的倍率性能(4000 C)。NH4+储能也具有较高的倍率性能(150-500 C),如图5c所示,而大部分的金属离子储能的倍率性能较差(低于100 C),不太适合快速充电。
• 循环性能。非金属阳离子电池通常比非金属阴离子电池具有更高的循环寿命。非金属阳离子由于体积较小,在充放电过程中电极结构变化较小。相比之下,非金属阴离子电池会出现循环不可逆转性和溶解问题,导致循环性能较低。另一方面,非金属离子和金属离子在使用同一电极材料时循环稳定性的差异,可以归因于金属离子的高电荷密度,如Li+与电极产生强烈的静电相互作用,导致电极的不可逆结构变化和溶解。
文献信息:
Non-metallic charge carriers for aqueous batteries,Nature Reviews Materials,2020.
Non-metallic charge carriers for aqueous batteries,Nature Reviews Materials,2020.
https://www.nature.com/articles/s41578-020-00241-4
免责声明:本文仅代表作者个人观点,与中国电池联盟无关。其原创性以及文中陈述文字和内容未经本网证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
凡本网注明 “来源:XXX(非中国电池联盟)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
如因作品内容、版权和其它问题需要同本网联系的,请在一周内进行,以便我们及时处理。
QQ:503204601
邮箱:cbcu@cbcu.com.cn
猜你喜欢
-
崔屹&H.N. Alshareef:无负极水系锌-二氧化锰电池
2021-01-22 11:37 -
大连化物所研发出耐低温水系锌基电池用电解质溶液
2020-08-31 11:52 -
广东工业大学《JACS》:一种全新的高性能水系可充电铝离子电池!
2020-08-31 09:54 -
-78℃超低温水系电池!
2020-06-16 10:27 -
香港利用护肤霜成分制电解质 制成不易燃且安全的水系锂离子电池
2020-06-11 08:43 -
最新研发绿色水系电池进入国家电网光储能系统
2020-06-09 11:09 -
中南大学唐有根-王海燕团队在水系锌离子电池研究方面推出新成果
2020-05-13 10:24 -
新型水系锂离子电池更安全、性价比更高
2020-01-13 10:36 -
水系锂电池获关键突破,能量密度超 300Wh/kg,或成电池发展未来
2019-06-10 22:09 -
科学家利用新型卤素转换插层化学 打造高能锂离子水系电池
2019-05-24 09:33
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
专题
相关新闻
-
崔屹&H.N. Alshareef:无负极水系锌-二氧化锰电池
2021-01-22 11:37 -
大连化物所研发出耐低温水系锌基电池用电解质溶液
2020-08-31 11:52 -
广东工业大学《JACS》:一种全新的高性能水系可充电铝离子电池!
2020-08-31 09:54 -
-78℃超低温水系电池!
2020-06-16 10:27 -
香港利用护肤霜成分制电解质 制成不易燃且安全的水系锂离子电池
2020-06-11 08:43 -
最新研发绿色水系电池进入国家电网光储能系统
2020-06-09 11:09 -
中南大学唐有根-王海燕团队在水系锌离子电池研究方面推出新成果
2020-05-13 10:24 -
新型水系锂离子电池更安全、性价比更高
2020-01-13 10:36
本月热点
-
2020年锂电池行业研究报告
2021-05-11 11:24 -
突发|深圳一锂电企业停止经营、解散员工!
2021-05-11 10:02 -
4月我国动力电池装车量同比上升134.0%
2021-05-13 08:26 -
如何看待Pack内铁锂和三元混用
2021-06-01 09:25 -
可充电中性锌空气电池:进展,挑战和未来
2021-05-19 10:59 -
揭开赣锋锂业的家底
2021-06-03 09:46 -
“电池荒”来袭,生产纯电动汽车的车企要被卡脖子了?
2021-06-01 21:22 -
关于征集《锂离子电池用连续式真空干燥系统技术规范》等两项行业标准的函)征求意见程序
2021-05-31 22:53
 企业微信号
企业微信号 微信公众号
微信公众号









